研究について
ユビキチンリガーゼによる細胞周期制御
細胞周期を制御する分子群は、適切な時期に適切な量を発現していることが求められています。そのような繊細な発現量調節を可能にしているのが、ユビキチン-プロテアソーム系によるタンパク質分解であると言われています。
私たちは、細胞周期の進行を抑制する p27とその発現量を調節しているユビキチン化酵素 Skp2 の関係を調べることで、p27が適切な時期にSkp2によって分解されることが正常な細胞周期の進行に必須であることを示しました。
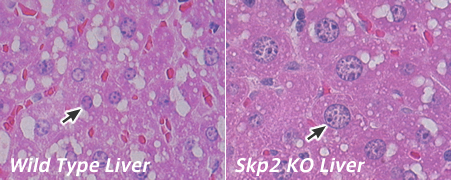
逆に、細胞周期を進行させることが知られているc-Mycの発現量を調節しているユビキチン化酵素 Fbxw7の機能を調べると、T細胞や表皮細胞の増殖と分化に重要な働きをしていることが分かりました。
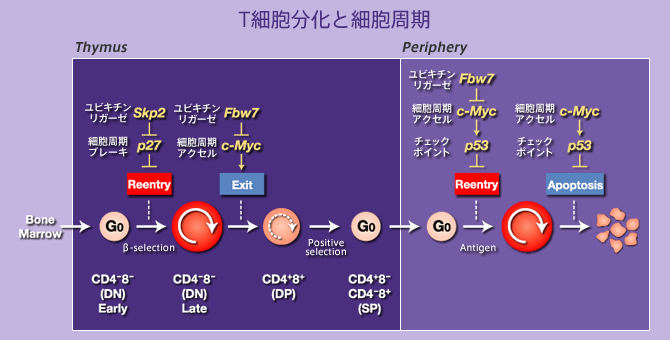
増殖ステージへの進入(Reentry)をp27は抑制し、逆に増殖の停止(Exit)をc-Myc は抑制している。
このことは、細胞周期制御タンパク質量を的確に制御することで、生体内での細胞の増殖とその機能、分化が適切にコントロールされていることを示しています。
現在は、表皮細胞やB細胞での増殖と分化に対するタンパク分解の役割を調べることで、組織間で増殖と分化制御にどのような共通性があるのか、また相違が生じるのはどのような機構なのかを明らかにしたいと考えています。
細胞増殖と分化の分岐点を制御するGeminin
Gemininは、細胞が増殖するとき、特に染色体の複製に重要な働きをしている分子として発見されました。実際、私たちがGeminin 欠損マウスを作製したところ、受精後わずか2日から3日目に、細胞増殖ができずに死んでしまうことがわかりました。
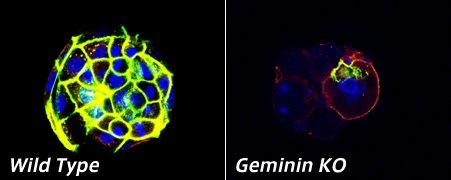
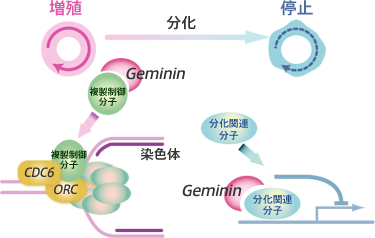
一方で、Geminin は、様々な分化関連因子と結合し、その機能を制御していることが知られています。すなわちGeminin は細胞が増殖へ向かうのか、分化へ向かうのかを規定している分子と考えられます。
どのようなメカニズムで、Gemininが結合タンパク質の選択を変え、増殖から分化へと遷移するのかを探求することが私たちの目標です。
DNA損傷に対する反応性を規定する RNF
細胞内のDNAは常に様々な要因によって損傷を受けており、それらを放置すれば細胞死や突然変異、ひいては細胞老化や癌化、遺伝病発症などを引き起こします。そのような事態を避けるために生物はDNA損傷修復機構を持っています。
私たちは、新規のユビキチン化酵素RNFがDNA損傷部位に集まり、二本鎖切断修復に重要な働きをするKu70/Ku80複合体をユビキチン化して損傷修復反応を制御することを発見し、研究を進めています。
Ras による遺伝子サイレンシングの分子メカニズム
正常な細胞には、アポトーシスや細胞老化など、細胞のがん化を抑制する機構が備わっています。しかし、がん細胞は、これらのがん抑制機構で働く遺伝子を不活性化したり、その発現を安定に抑制することで、がん抑制機構を回避し、その悪性度をさらに高めていきます。
細胞の増殖を制御しているRas遺伝子は、ヒトのがんの約30%で突然変異が起きている遺伝子で、細胞のがん化と密接に関係しています。がん誘導性の突然変異をもつRasタンパク質は、細胞の増殖を著しく亢進させる一方で、アポトーシスの誘導に関わる遺伝子や、がん細胞の浸潤・転移を防ぐ遺伝子の発現を抑制することが知られています。
私たちは、がん誘導性Rasによって引き起こされる、がん抑制遺伝子のサイレンシング(遺伝子の不活化や発現抑制)の分子メカニズムを解明して、がん治療の新しい分子標的を明らかにしたいと考えています。