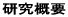以下に現在行っている研究テーマと得られた結果を簡単に示します。
・細胞周期を負に制御する因子p27の機能解析
私たちの体を構成する細胞を観察すると、激しく増殖している細胞(例えば骨髄幹細胞)と、ほとんど増殖が観察されない細胞(例えば神経細胞)が共存していることがわかります。「増殖」という特徴で分類すると、増殖を停止した細胞群は必ずサイクリン依存性キナーゼ阻害分子(CDK Inhibitors: CKI)が強く発現しています。そこで私たちは、「これらの分子が生理的条件下では増殖を制御し、その破綻ががんにつながるのではないか」、と考えてこれらの分子の機能解析を行ってきました。
私たちはCKIの中でも最も分化と増殖制御に関連の高いp27という分子に注目し、その遺伝子を人工的に破壊したノックアウトマウスを作製しました。すると、マウスの体全体が大きくなり (図1参照)、特に免疫系、神経系、生殖器系の臓器が著しい過形成を示すことから(図2参照)、 p27は個体や臓器の大きさを規定している分子であることがわかりました。またこのマウスは下垂体に腫瘍を頻発し死亡することから、p27は癌抑制遺伝子であることも明らかとなりました。臨床的にもp27の発現が低い腫瘍は悪性度が高いことが報告されていますが、p27遺伝子に変異を持つ腫瘍はみられず、むしろp27タンパク質の安定性が発現調節にとって重要であることがわかりました。この安定性は、ユビキチン・プロテアソーム系によるp27のタンパク質分解によって調節されていることが知られています。
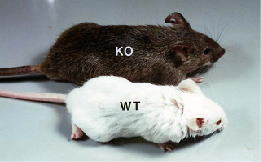
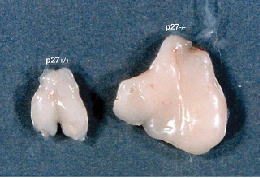
図1 図2
p27は、Skp2を含むユビキチンリガーゼによってユビキチンを付加され、プロテアソームによって分解されることが報告されました。そこでSkp2のノックアウトマウスを作製したところ、p27の異常な蓄積が認められ、細胞核が巨大化し、中心体が過剰に存在すること (図3参照)が明らかとなりました。
ところが予想に反して、Skp2ノックアウトマウスのリンパ球を用いた解析では、G0-G1移行期の p27の分解は正常と同じように起こることがわかりました。一方、S-G2期におけるp27の分解は Skp2がないと起こらなくなっていました。つまりG0-G1移行期における急速なp27の分解は、 Skp2依存的分解以外の分解機構によって生じることが示唆されました。また私たちは、 G0-G1移行期にp27は核から細胞質へ移行した後に分解されること、この核外移行は10番目のセリン残基のリン酸化に依存しているが、Skp2に依存しないことを観察しています (図4参照)。現在、この核外移行が細胞が静止期から細胞増殖へむかう引き金であると考え、分子機構の解明を目指しています。
図3
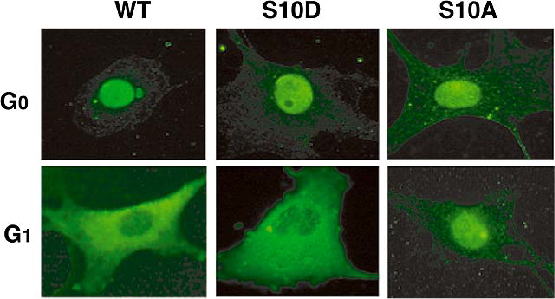
図4
・分化抑制分子 EIDの機能解析
RB (retinoblastoma)遺伝子は、世界で初めて同定された癌抑制遺伝子です。RBタンパクは細胞周期を正に制御する転写因子E2Fに結合し、その機能を阻害することによって、細胞周期を停止させる機能を持つことが知られています。一方、RBは分化の進行を正に制御する機能を併せ持つことも知られていましたが、その分子メカニズムは不明でした。私たちは、 RB結合タンパクとして、分化を抑制する分子EID-1 (E1A-like inhibitor of differentiation-1)を発見し、RBがEID-1の機能を阻害することによって分化を正に制御することを明らかにしました。 EID-1の分化抑制の機序は、分化を促進する転写共役因子p300のヒストンアセチル化酵素(HAT)活性を阻害することによります。私たちはさらにEID-1類縁分子としてEID-2 (EID-1-like inhibitor of differentiation-2)をクローニングしましたが、 EID-2も分化抑制機構を持つことが明らかになりました。ただEID-2はEID-1と異なり、ヒストン脱アセチル化酵素(HDAC)と結合しますが、その分化抑制のメカニズムはまだ明らかではありません。現在、RBの分化促進機構および新規分化抑制因子EIDファミリーを中心として、分化と細胞周期調節機構の関連、これら分化調節因子と発生、ヒト疾患との関わりについて研究を進めています。
・Wntシグナル系制御分子 b-TrCP1の機能解析
Wntファミリーは、マウスの癌遺伝子として発見されましたが、同時にアフリカツメガエルやショウジョウバエの研究から発生初期において背腹パターン化、分節の形成などの鍵となる分子であることが示されています。そのシグナル伝達経路は詳細に調べられ、発がんと関与も多く示唆されています。この経路の中心的分子であるb-カテニンの発現量もp27と同じく、ユビキチン・プロテアソーム系によるタンパク質分解によって調節されていますが、私たちはこの分解がb-TrCP1を含むユビキチンリガーゼが制御していることを見出し、そのノックアウトマウスの作製を行いました。現在、発生過程への影響とともに発がんへの関与を念頭に解析を進めています。